幹細胞は自己複製能力と、様々な細胞に分化する能力を持つ特殊な細胞です。この2つの能力により、組織の再生を担う細胞であることが分かっており、近年、再生医療や美容への応用など多くの分野で注目を浴びています。
幹細胞を培養した際に幹細胞から分泌されるタンパク質成分を含んだ培養液を、幹細胞培養液と呼び、中でもヒト由来の幹細胞培養液をヒト脂肪幹細胞培養液と呼びます。
TEL
ヒト幹細胞培養液とは?
INANNA
幹細胞は自己複製能力と、様々な細胞に分化する能力を持つ特殊な細胞です。この2つの能力により、組織の再生を担う細胞であることが分かっており、近年、再生医療や美容への応用など多くの分野で注目を浴びています。
幹細胞を培養した際に幹細胞から分泌されるタンパク質成分を含んだ培養液を、幹細胞培養液と呼び、中でもヒト由来の幹細胞培養液をヒト脂肪幹細胞培養液と呼びます。
ヒト幹細胞培養液は、老化によって活性の低下した細胞を呼び覚ます成分として、様々な効果を発揮し、コラーゲン・ヒアルロン酸生合成促進、シワ改善・防止、美白、線維芽細胞増殖、幹細胞増殖、表皮細胞増殖、増毛・発毛など、アンチエイジングを実現する様々な効果が確認されています。
ヒト脂肪幹細胞培養液は、骨髄幹細胞や臍帯血幹細胞などよりも容易に採取でき、しかも幹細胞の含有量が多いため、近年、医療や化粧品の原料として多く活用が進んでいます。
ヒト由来脂肪幹細胞培養液は幹細胞が作る500種類以上のタンパク質成分を含有します。そこには、特定の細胞の増殖や分化を促進する内因性のタンパク質である成長因子が200種類以上含有することが報告されています。
表皮幹細胞に表皮細胞増産のシグナルを出し、ターンオーバーを促進、シミ、くすみを改善します。
肌組織においては細胞増殖促進、細胞運動促進、抗アポトーシス、形態形成誘導、血管新生など組織再生に関わります。
真皮幹細胞に肌細胞の増殖を促します。
線維芽細胞に、コラーゲン、エラスチン、ヒアルロン酸、SOD等の増産シグナルを出し、創傷治癒、シワ改善、美白効果をもたらします。
細胞線維芽細胞の増殖を促進します。
血管、皮膚、筋肉などの細胞に作用し、細胞の分化、増殖を制御します。
破損している細胞の再生をサポートします。
新しい皮膚を再生し、コラーゲンやエラスチン、ヒアルロン酸の生成を促進します。
それによってシワの解消や予防しハリや弾力を再生します。
毛母幹細胞に働きかけ、発毛、増毛効果があります。
抗炎症効果等があり、敏感肌の改善効果があります。
新生血管を形成するための大きな役割を果します。

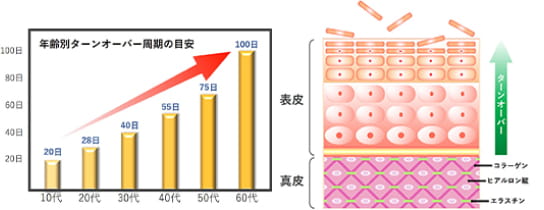
皮膚老化と損傷を防止し、皮膚組織の主要構成成分であるヒアルロン酸、コラーゲン、エラスチンの再生を促進し、加齢などにより長期化した肌のターンオーバーを正常化する高機能素材です。
幹細胞培養液成分の生理的活性は、抗老化効果、組織再生効果など、様々な効果が確認されています。
近年の再生医療、そしてヒト幹細胞培養液の登場は、美容においても大きな転換期となりました。
弊社では国内最大規模の研究施設で開発、製造、管理された安全なヒト脂肪幹細胞培養液のみを使用しています。
長年の研究で蓄積された優れた培養技術により、質の高い培養液を安定的に生産することが可能となっています。また製造環境、原料、ドナーなどには、極めて厳しい基準を設け、徹底した管理のもとで生産されています。
原料となる脂肪幹細胞は、様々な種類の幹細胞の中でも、採取が容易で、安全性が高く、その有効性が多岐にわたるため、医療や化粧品への活用には大変優れた素材です。
100%純国産
100%ヒト由来
(動物由来成分完全不含有)
脂肪幹細胞
「医薬品GMP」準拠技術施設
(大手製薬会社との共同研究時の技術を採用)
「特定細胞加工物製造許可」
(厚生労働省認定)
GMP(Good Manufacturing Practice)とは、製造業者および製造販売業者に求められる「適正製造規範」(製造管理・品質管理基準)のことです。
品質管理とは、医薬品等の原材料の入荷、検品から製造、製品の包装、出荷管理、製品保管、回収処理などに係る業務です。
医薬品製造においては薬事法に基づくGMP省令を遵守することが定められています。臨床試験を実施する医療機関等にも適用されます。
製造所の構造設備に関しては、清掃、定期点検、校正を適切に行い、品質が維持される衛生的な設備とし、その際「薬局等構造設備規則」(厚生労働省令)も遵守しなければならなりません。
他に、原薬、無菌医薬品、生物由来医薬品等の製造管理、品質管理などの規定があります。GMPは、FDA(アメリカ食品医薬品局)が、1962年、「医薬品、連邦食品、化粧品法」に取り入れた「薬品の製造規範」をベースに、世界保険機関がWHO-GMPを制定し、1969年に国連総会で採用勧告されました。
「特定細胞加工物製造許可」は、再生医療等の安全性の確保等に関する法律第35条第1項の規定に基づいた制度です。医療機関を始めとする再生医療等の提供機関ならびに研究機関における細胞培養の受託を指します。(2015年10月7日取得)
弊社商品のINANNAは、
厚生労働省の規定よりもさらに厳しい、
徹底した安全試験をクリアしています。
ヒト幹細胞培養液
安全試験項目の比較
□ 韓国(食品医薬品安全庁)規定5項目
□ 日本(厚生労働省) 規定6項目
□ INANNA採用原料 〔規定6項目 + 24項目〕×3回
INANNAの試験項目
[ 実施機関
日本食品分析センター ]
・皮内反応試験
・皮膚感作性試験
・急性全身毒性試験
・反復全身毒性試験
・皮膚一時刺激性試験
・抗原性試験
・累積皮膚刺激性試験
培養上清の
感染症リスクに
関する安全性確認
ドナースクリーニング項目
1.HIV
2.HCV抗体
3.HBs抗原
3.HBe抗原
4.HTLV-I抗体
5.梅毒(RPR法)
6.梅毒(TPHA法)
7.単純ヘルペス
8.マイコプラズマ
9.パルボウイルスB19
品質管理試験項目
1.ヒト免疫不全ウイルス1型
2.ヒト免疫不全ウイルス2型
3.ヒトT細胞白血病ウイルス1型
4.ヒトT細胞白血病ウイルス2型
5.C型肝炎ウイルス
7.B型肝炎ウイルス
8.エプスタイン・バール・ウイルス
9.サイトメガロウイルス
10.ヒトパルボウイルスB19
11.単純ヘルペスウィルス1型
12.単純ヘルペスウィルス2型
13.水痘・帯状疱疹ウイルス
14.ヒトヘルペスウイルス6型
15.ヒトヘルペスウイルス7型
16.ヒトヘルペスウイルス8型-
17.アデノウイルス
18.ヒトポリオーマウイルス(JCV)
19.ヒトポリオーマウイルス(BKV)
20.ヒトパピローマウイルス
21.マイコプラズマ
日本国内での生産に徹底し、
厳選した素材を多数配合した